

La facilidad con que se puede llegar al diagnóstico de la fibrosis glútea y el hecho de que la mayor parte de los trabajos publicados lo han sido en base a un corto número de casos, hace que muchos de estos artículos adolezcan de una confirmación anatomopatológica de la lesión. Pensamos que éstas podrían ser dos de las razones más importantes que justificasen el conocimiento ultraestructural tan somero que se tiene de la misma.
Por ello, el análisis morfológico e histopatológico de las entidades afectas representa no sólo un elemento de diagnóstico, sino también una valiosa fuente de información patogénica.
Para obtener un resultado óptimo en la interpretación de los hallazgos anatomopatológicos hemos de tener presente una serie de consideraciones técnicas:
Nosotros tomamos las muestras de piel y tejido celular subcutáneo del borde de la herida quirúrgica. Del músculo glúteo mayor obtenemos dos piezas biópsicas: la primera de una de las zonas en que macroscópicamente se observa la presencia de tejido fibroso. Por regla general, estas zonas se hallan en el cuadrante craneomedial de dicho músculo (en la vecindad de la cresta ilíaca y del borde de la carilla auricular del sacro), junto al trocánter mayor y en las proximidades de la inserción femoral (fig. 103). La segunda muestra se toma de un área alejada de la lesión.
Si hemos de obtener alguna biopsia adicional de cualquier otro músculo, seguimos la misma pauta que para el músculo glúteo mayor.
Todas estas escisiones tienen un tamaño medio aproximado de 3 x 0,5 x 0,5 cm (longitud x anchura x altura) y son practicadas al inicio de la intervención, antes de que las manipulaciones, la electrocoagulación y otras agresiones pudieran enmascarar las modificaciones histológicas de los tejidos a estudiar.
Las muestras obtenidas se destinan a tres tipos de análisis: histopatología convencional, histoquímica-morfometría y microscopia electrónica, para los que se requieren diferentes medios de fijación: bien sea con formol neutro al 10 % para el primer caso; bien congelando la pieza con nitrógeno líquido previa inmersión en 2-metil butano enfriado para el segundo; o incluyéndolo en una solución de glutaraldehído para la microscopía electrónica.
En ninguno de los trabajos consultados se hace referencia al uso de la morfometría ni la microscopía electrónica, y tan sólo Botto [87] ha utilizado el método histoquímico de la peroxidasa para poner en evidencia la actina en el estudio de este proceso.
Las técnicas de tinción utilizadas por nosotros han sido la de hematoxilina eosina (HE), tricrómico de Gomori (TG) y de Van Giesson (VG), hemotoxilina fosfotúngstica de Mallory (PTAH), orceína (ORC), ácido peryódico de Schiff (PAS) e inmunoperoxidasa (IPO), para la microscopía convencional; y las técnicas de adenosintrifosfatasa míosínica (ATP-asa pH 9,4) y difosfopiridin-nucleótido (DPNH) para la morfometría.
El análisis de nuestros hallazgos tras confrontarlos con las descripciones hechas por otros autores nos lleva a considerar que el aspecto histológico dominante en la fibrosis glútea es la riqueza del tejido conectivo colágeno en la región de la nalga, tejido que puede estar presente de forma difusa, cordonal o en placas, según Esteban [21].
Cuando se presenta difusamente se extiende a uno o varios músculos, con participación del tejido fibroso perimuscular y de las fascias, llegando a afectar, en los casos más evolucionados, a la cápsula articular [47, 65]. Es la forma más frecuente (fig. 123).
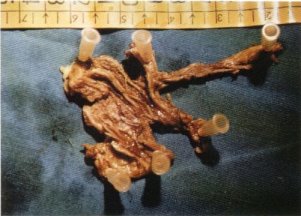
Fig. 123. Placa de fibrosis (9x5 cm) extirpada de la fascia superficial del músculo glúteo mayor.
Se habla de fibrosis en cordón o en bandas cuando la lesión se muestra a modo de cuerda de tejido cicatricial fibrótico (fig. 102) rodeada de músculo normal y extendiéndose a lo largo del músculo. De longitud variable, puede llegar a cruzar el músculo glúteo mayor desde su inserción ilíaca hasta la línea áspera del fémur [66]. Es la forma de presentación más rara, según Houmai [17].
Las placas de fibrosis se caracterizan por estar rodeadas de tejido muscular normal (fig. 101), lo que hace pensar que se trata de una fibrosis cicatricial, hipótesis avalada por el hecho de que, en ocasiones, coinciden con sitios de inyecciones, como se demuestra al identificarse reacciones granulomatosas a cuerpo extraño en su vecindad [21, 86].
Por otra parte, Viladot [15] considera que los cambios tendinofasciales existentes pueden mostrarse como un engrosamiento fibroso con adherencias al tejido neoformado, o como una sustitución fibroadiposa del músculo que determinará una atrofia simple y/o una modificación de los diferentes componentes de las estructuras tenofasciales.
A pesar de estas consideraciones, es preciso decir que lo habitual es una presentación mixta de las distintas formas de fibrosis.
Las fibras de este tejido conectivo colágeno neoformado se encuentran en su mayor parte agrupadas longitudinalmente formando gruesos septos fibrosos [13, 15-18, 20, 45, 47, 64, 71, 73, 76, 78, 83-85, 161, 242] (fig. 124) que podrían justificarse como un signo de inflamación subaguda del tejido muscular de etiología desconocida [15]; en ellos se identifican células fusiformes consideradas como miofibroblastos [87] por resultar positivas a la reacción enzimática que evidencia a la actina, células que también pueden observarse en otros procesos como las cicatrices queloideas o la enfermedad de Dupuytren.
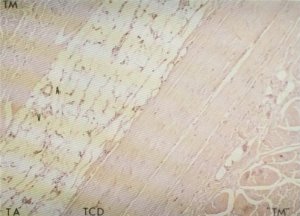
Fig. 124. Bandas de tejido colágeno denso (TCD) separadas por tejido adiposo (TA) flanqueadas, «aparentemente», por fascículos de tejido muscular (TM y «TM»), vistas tras ser teñidas con hematoxilina eosina (HE).
En ocasiones, se disponen estas fibras colágenas de forma sinuosa y ondulante, estando separadas entre sí por tejido conectivo laxo que se alterna con áreas de infiltración adiposa [15-17, 20, 85] (fig. 125) en las que se localiza un variable número de fibroblastos alargados con núcleos fusiformes y, a veces, en forma de sacacorchos [16].
La dirección paralela de las fibras colágenas correspondientes a la primera modalidad puede reproducir un patrón seudotendinoso, o bien seudomuscular, en especial cuando se observa con microscopio a pocos aumentos. Esta semejanza con el músculo es debida a la existencia de una aparente estriación transversal, también observada por Fernández [16], y a la adopción de un agrupamiento similar al de las fibras musculares, lo que ha hecho sugerir a Beguiristain [73] la existencia de una transformación del tejido muscular en conectivo. Por tanto, nos vemos obligados a utilizar técnicas de tinción específicas para cada tipo de tejido y de este modo evitar un posible error diagnóstico (fig. 126). La adopción de una u otra morfología probablemente venga determinada por el papel mecánico y/o funcional que desempeñan estas fibras.
La distribución de uno u otro tipo de tejido conectivo es diferente, si bien pueden coexistir. El tejido conectivo laxo se localiza fundamentalmente en la periferia del fascículo (fig. 127), en tanto que el tejido conectivo denso predomina en la parte central del mismo, zona en la que el escaso tejido adiposo existente se dispone delimitando las gruesas bandas de colágeno en el intersticio interfibrilar (figs. 124 y 126). Ello sugiere que el proceso de sustitución tisular que está ocurriendo tiene un sentido centrífugo, lo que se contrapone con la opinión de Pipino [77], seguida por Viladot [15], Fraga [20] y Palanca [76], de que este fenómeno se inicia en la fascia del músculo y afecta secundariamente al mismo. Sin embargo, justificaría la hipótesis ya enunciada por Fernández Valderrama [16] de que la intensidad de la fibrosis pudiera estar relacionada con el tiempo de evolución del proceso y la edad del paciente, de tal manera que los niños mayores y adultos tienen un tejido fibroso más maduro y denso que los niños de menor edad en los que se observa menor fibrosis, fenómeno que puede recordar una distrofia muscular miotónica.
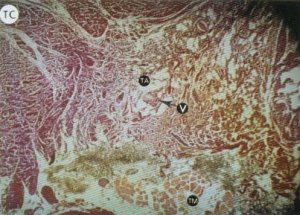
Fig. 125. El tricrómico de Van Giesson (VG) tiñe selectivamente el colágeno de rojo, lo que nos permite observar la escasez de fibras musculares (TM) frente a la abundancia de tejido colágeno (TC) que simula la distribución fascicular del músculo. En el espesor del tejido adiposo (TA) se observan vasos de mediano calibre (V).
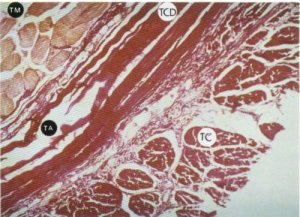
Fig. 126. Con esta tinción (VG) podemos observar que aunque «aparente» ser tejido muscular que flanqueaba las bandas de tejido colágeno denso («TM») y que veíamos en la figura 124, en realidad es tejido colágeno (TC) dispuesto perpendicularmente a los antedichos tractos fibrosos (TCD) que simula perfectamente la distribución fascicular del músculo (TM).
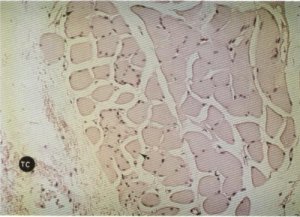
Fig. 127. El tejido conectivo (TC) se dispone fundamentalmente en la periferia del fascículo y posteriormente infiltra al mismo desestructurándolo, pudiéndose apreciar, en ocasiones, una centralización nuclear(■→)
Esta riqueza de tejido colágeno, así como su organización, ha inducido a diversos anatomopatólogos a considerar que se trata de una forma de fibromatosis [13]. En nuestra serie un caso fue informado por el Servicio de Anatomía Patológica como tal. Esta confusión puede estar justificada en la dificultad que entraña el diagnóstico exacto de los tumores de tejido fibroso del esqueleto muscular, los cuales son divididos en cuatro grupos por Enzinger y Weiss [243]: tumores benignos y lesiones seudotumorales, fibromatosis, proliferaciones fibrosas de la infancia y recién nacidos, y fibrosarcomas.
En las estructuras tenofasciales se aprecia una disminución de la celularidad y sobre todo una alteración de la sustancia fundamental, donde se pueden evidenciar algunas zonas basófilas con cavidades seudoquísticas y áreas de degeneración mixoide intratendinosa en su entorno.
Por último, también se ha señalado que en algunos casos el conectivo fibroso se transforma en conectivo de tipo osteoide con pequeños focos de calcificación [87] en los que se puede apreciar gran cantidad de elementos histiocitarios y de células gigantes [86]. Este hecho no ha podido ser constatado por nosotros.
Las lesiones antes descritas se corresponden macroscópicamente con zonas más o menos extensas de tejido muscular de color blanquecino o amarillento y de consistencia variable, según que predomine el tejido fibroso o el adiposo. Estas áreas tisulares se hallan inmersas en un músculo aparentemente normal y de superficie externa irregular, consistencia firme al corte y coloración pardusca o grisácea.
Sin embargo, microscópicamente se puede observar cómo bajo esta apariencia de normalidad el músculo se encuentra sustituido total o parcialmente por tejido conectivo, que infiltra las estructuras vasculares, nerviosas y fasciales del mismo (figs. 125 y 128), y que se puede encontrar tanto en el perimisio como en el endomisio (fig. 129).
Los haces musculares se desestructuran de forma progresiva, primero constituyendo pequeños acúmulos celulares (fig. 130), posteriormente adoptando una disposición anárquica (fig. 131) y, por último, desapareciendo; de este modo el fascículo llega a perder su identidad. Al igual que sucedía con la distribución del tejido conectivo, las lesiones musculares más graves las hemos podido observar generalmente en el centro del fascículo (fig. 132), lo que nos permite ratificarnos en la idea de que este proceso de colagenización tiene un sentido centrífugo.
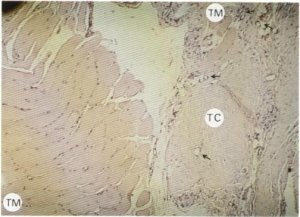
Fig. 128. El tejido conectivo (TC) engloba tanto el músculo (TM) como a los vasos y nervios (→).
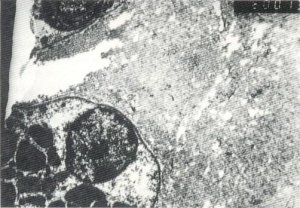
Fig. 129. El tejido fibroso está presente en el endomisio.
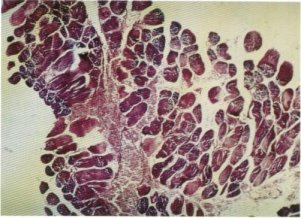
Fig. 130. El tejido fibroso infiltra el fascículo muscular formando pequeños acúmulos celulares.
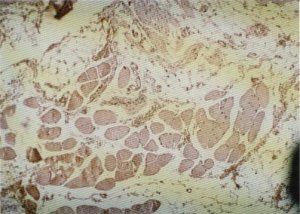
Fig. 131. En un estadio más avanzado la desestructuración fascicular es total, disponiéndose las fibras musculares de forma anárquica
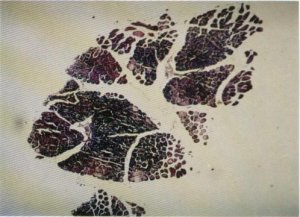
Fig. 132. Visión panorámica de un haz muscular. Obsérvese cómo las fibras más lesionadas, las más teñidas, se encuentran en la parte central de los diferentes fascículos.
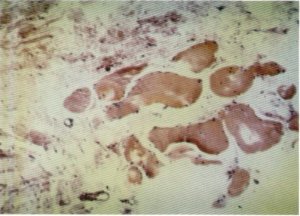
Fig. 133. Necrobiosis muscular.
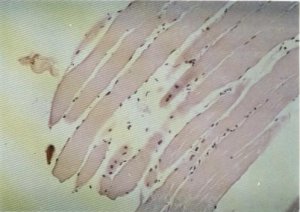
Fig. 134. Fragmentación de la fibra muscular.
En lo referente a los cambios histológicos que han sido detectados en las fibras musculares, cabe destacar la presencia de cambios degenerativos fibrilares con pérdida de la estriación transversa y homogeneización y eosinofilia citoplasmática [15,16, 20, 45, 75, 77, 84], en tanto que los núcleos, picnóticos, mantienen su posición periférica (fig. 133), fenómeno conocido como necrobiosis y que ha sido observado en el 68 % de los casos por nosotros estudiados. En ocasiones, el citoplasma se encuentra muy degenerado y adopta un aspecto granular [20], mientras que otras veces se pueden apreciar unas concentraciones sarcoplásmicas que producen un incremento de la estriación transversal, masas similares a las bandas de contracción de Nageotte propias de la distrofia miotónica [16]. Tales cambios pueden conducir a la fragmentación de la fibra muscular (fig. 134), siendo esporádicos los fenómenos de fagocitosis. En algunos casos se ha podido observar la existencia de pequeños depósitos de glucógeno muscular (fig. 135).
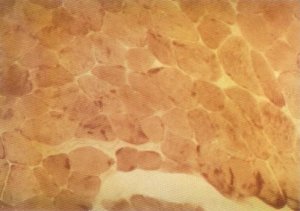
Fig. 135. Pequeños depósitos de glucógeno muscular.
En algunas células musculares también puede observarse una centralización nuclear (fig. 127) con hipertrofia de sus núcleos [16, 20, 78]. En ocasiones hemos podido apreciar cambios en el comportamiento histoquímico celular [101] que se concretan en la presencia de células descritas como «central core» (fig. 136), que presentan una hiperactividad enzimática oxidativa y una alteración en su distribución, lo que nos indicaría un posible origen primario de la lesión; ello contraviene la teoría de Pipino [77] de que éste es secundario a las alteraciones fasciales.
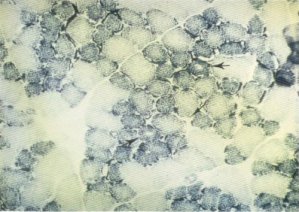
Fig. 136. Células «central core».
De igual forma se observan fibras descritas como «month-eaten fibers», apolilladas o en sacabocados (fig. 137). Son fibras en las que la actividad enzimática no es uniforme en toda la fibra, apareciendo en ésta múltiples focos de escasa o nula actividad y difusamente distribuidos, células que han sido descritas tanto en los procesos neuropáticos como miopáticos [138].
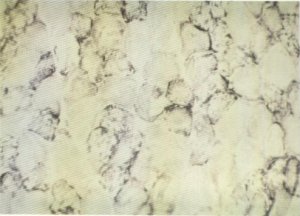
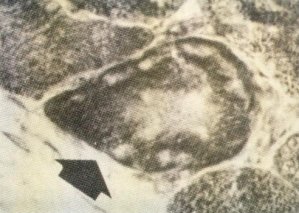
Fig. 137. Células en sacabocados o «month-eaten fibers».
Los hallazgos histoquímicos más relevantes fueron los cambios en la distribución de las fibras musculares. En este sentido se observó que los valores porcentuales de los distintos tipos celulares eran superiores a los presentados por Carpio [142] y Shagal [244] para el músculo normal, pero semejantes a los referidos por Dubowitz [138] para las enfermedades producidas por lesión de la motoneurona (fig. 138). También se pudo constatar el predominio existente en las fibras tipo 1 que se distribuían formando grandes agrupamientos fibrilares (figs. 139 A y B) sin presencia evidente de fibras atróficas; es más, tanto las fibras tipo 1 como las 2A y 2B presentaban un diámetro medio superior al considerado como normal por Shagal [244] y nosotros mismos [142] (figura 140), pero similar al encontrado por Swash [245] en la miopatía del músculo cuádríceps de origen nervioso central. Sin embargo, autores como Viladot [15], Fraga [20], Durán [75], Palanca [76], Pipino [77] y González Peña [78] señalan la existencia de una atrofia muscular simple que no recuerda a la atrofia neurógena, según Fernández Valderrama [16], en tanto que Hang [65] y Shan-mugasundaran [79] citan casos en los que se aprecia una morfología superponible a la de la atrofia neurógena con signos residuales de poliomielitis.
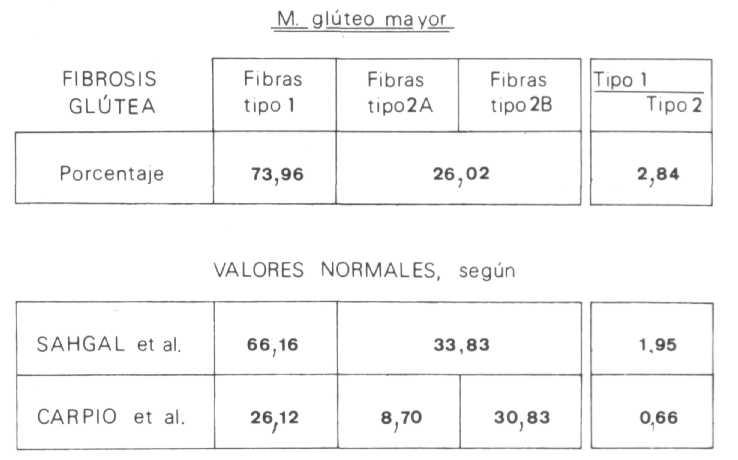
Fig. 138. Distribución porcentual de los diferentes tipos histoquímicos de fibras musculares del músculo glúteo mayor afecto de fibrosis glútea.
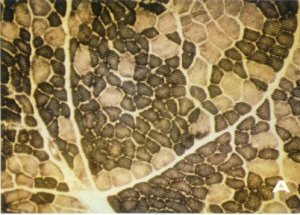
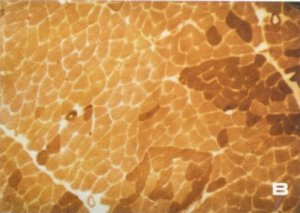
Fig. 139. En la fibrosis glútea existe una pérdida del aspecto en mosaico propio del músculo normal, puesto en evidencia mediante reacción histoquímica con NADH-tr (A) y ATP-asa a pH 9,4 (B).
No obstante, el análisis de los factores de atrofia e hipertrofia (fig. 141) respecto a los valores normales propuestos por Brooke [137], Dubowitz [138] y Carpio [142] nos permitió identificar la existencia de una clara atrofia de las fibras tipo 1 con hipertrofia de las de tipo 2B. Respecto a este factor de hipertrofia en la fibrosis glútea, no hemos encontrado referencias bibliográficas, aunque habría que tener en cuenta que la hipertrofia de las fibras tipo 2B ha sido referida por Dubowitz [138] como una consecuencia de la hiperactividad muscular.
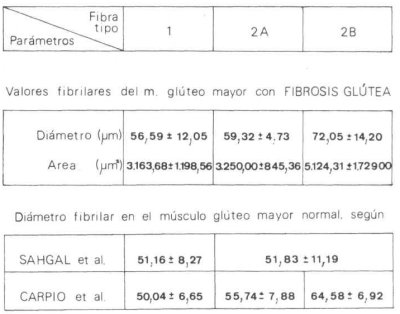
Fig. 140. Aspectos morfométricos de los diferentes tipos fibrilantes del músculo glúteo mayor afecto de fibrosis glútea: diámetro y área.

Fig. 141. Aspectos morfométricos de los diferentes tipos fibrilares del músculo glúteo mayor afecto de fibrosis glútea: factores de atrofia, hipertrofia y forma.
Por otra parte, el factor de forma nos indica la existencia de un contorno elipsoide en la casi totalidad de las fibras, observándose un escaso número de fibras con marcado contorno poligonal.
Esta distribución fibrilar ha sido descrita como una imagen característica de una reinervación secundaria a una denervación por lesión de la motoneurona [138, 245], denervación que podría venir dada por una constricción fibrosa del nervio, lo que determinaría que el músculo perdiese su imagen en mosaico y adoptase la de grandes agrupamientos.
Al margen de estos cambios, ocasionalmente se encuentran infiltrados linfocitarios perivasculares en el intersticio interfibrilar de escasa cuantía (fig. 142) [13, 16, 17, 20, 78, 85] que son buscados pero no hallados por Peiró [71] y Durán [75] y que nosotros hemos podido observar en tan sólo cuatro casos. Por ello no se puede probar la existencia de un factor inflamatorio implicado en el origen y evolución de la enfermedad.
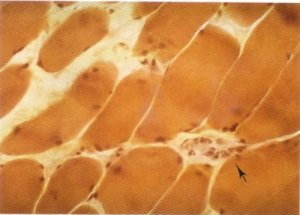
Fig. 142. Infiltrado linfocitario perivascular.
La vascularización del músculo afecto es moderada o escasa [13, 20, 78] y bien estructurada [20], dispuesta fundamentalmente en el tejido conectivo laxo [76].
Si bien Fraga [20] no encuentra alteraciones morfológicas en los vasos, Fernández [16] y Houmai [17] citan una intensa fibrosis perivascular, mientras que Botto [87] aprecia sólo en los pequeños vasos algunas áreas con leves signos de espesamiento de la pared. Por otra parte, Pipino [77] fue el primero en señalar la existencia de varices y estasis venosas (fig. 143), también observadas por nosotros y a las que se les ha dado un papel etiopatogénico importante.
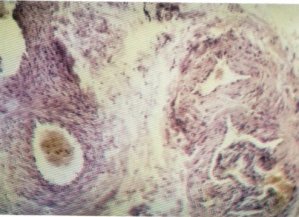
Fig. 143. Detalle de vasos venosos rodeados de abundante tejido colágeno.
Nuestros hallazgos contravienen en parte a los ya descritos, dado que encontramos abundantes estructuras vasculares dispuestas en el intersticio interfibrilar tanto del tejido muscular (fig. 144) como del conectivo laxo (figs. 125 y 128) y entre las bandas de tejido colágeno denso cuando éste adopta una disposición seudotendinosa.
Los vasos encontrados son principalmente de tipo arteriolar y, en menor cuantía, de pequeño calibre en torno a los que no se apreciaban signos de fibrosis (10 %), o ésta es moderada o escasa (fig. 145), siendo tan sólo un 10 % de los casos los que presentaban una intensa fibrosis perivascular.
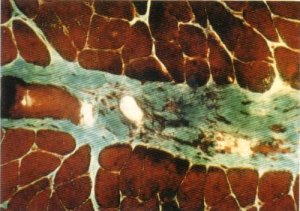
Fig. 144. Los vasos se suelen disponer en el Intersticio interfibrilar.
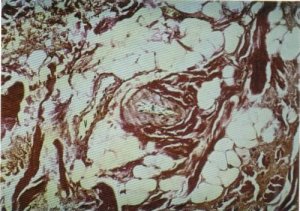
Fig. 145. Los vasos arteriales se encuentran rodeados de una moderada fibrosis.
Respecto a la presencia de estructuras nerviosas, son pocos los autores que se hacen eco de este hecho. Entre ellos, tan sólo Fraga [20] encuentra tractos nerviosos ligeramente hiperplásicos con intensa fibrosis perineuronal.
En nuestro estudio hemos detectado una merma importante de estructuras nerviosas en la casi totalidad de los casos, siendo la ausencia total en el 30 % de los mismos.
Los nervios, de calibre pequeño o mediano, se localizaron fundamentalmente en el estroma conectivo y adiposo (fig. 146) y, en muy pocas ocasiones (15 %), en el tejido muscular, disponiéndose principalmente en la periferia del fascículo formando parte de paquetes vasculonerviosos (fig. 147). Tan sólo en un caso hemos podido encontrar una hiperplasia nerviosa.
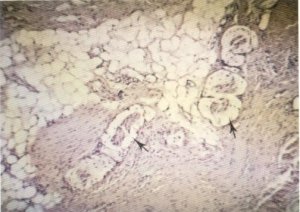
Fig. 146. Sin embargo, los nervios pueden estar inmersos en una intensa fibrosis.
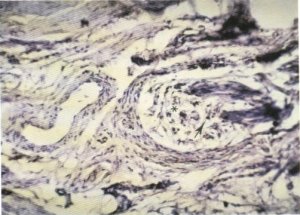
Fig. 147. Fibrosis que se detecta en el interior del nervio (*), observándose una disminución en el número de axones (→)
En torno a los tractos nerviosos se aprecia una fibrosis perineuronal en todos los casos, siendo intensa tan sólo en un 7 %. Estos fascículos nerviosos presentan una desestructuración con pérdida de fibras nerviosas y evidente, aunque escasa, fibrosis endoneuronal (fig. 147). Esta pérdida manifiesta de filetes nerviosos avalan los cambios histoquímicos musculares anteriormente citados, así como la pérdida de estriación y presentación de fragmentación fibrilar.
Por último, mencionar que a pesar de que la fibrosis glútea es una afección muscular, en los pacientes afectos se ha podido detectar una serie de alteraciones anatomopatológicas en el tejido celular subcutáneo y en la piel [17, 21, 65, 77, 83], caracterizadas por la presencia de tractos conjuntivales que desde la fascia glútea superficial llegan a ella atravesando la hipodermis (fig. 148).
En diferentes ocasiones se han encontrado reacciones granulomatosas de cuerpo extraño secundarias a medicamentos [16, 18, 21, 83, 85], lo que ha hecho sugerir la existencia de una relación causa/efecto entre las inyecciones intramusculares y la aparición de la enfermedad. En nuestra serie sólo hemos encontrado este hallazgo en dos casos (fig. 149), en tanto que otro presentaba un granuloma lipofágico (fig. 150).
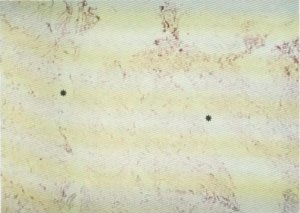
Fig. 148. Los tractos de tejido conectivo (*) cruzan, desde el plano musculoaponeurótico hasta la piel, el tejido celular subcutáneo.
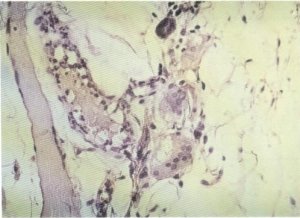
Fig. 149. Granuloma de cuerpo extraño.
La piel es alcanzada por el tejido fibroso que proviene de la zona fascial , siendo esta fibrosis la responsable de las retracciones que presenta, observables tanto clínica como anatomopatológicamente (fig. 151).
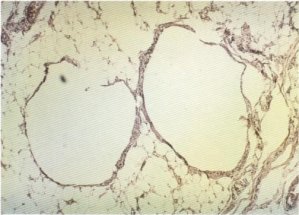
Fig. 150. Granuloma lipofágico.
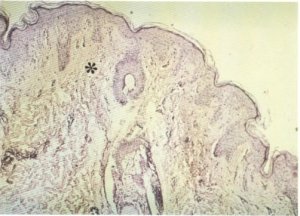
Fig. 151. La piel también presenta una mayor riqueza de tejido conectivo (*).